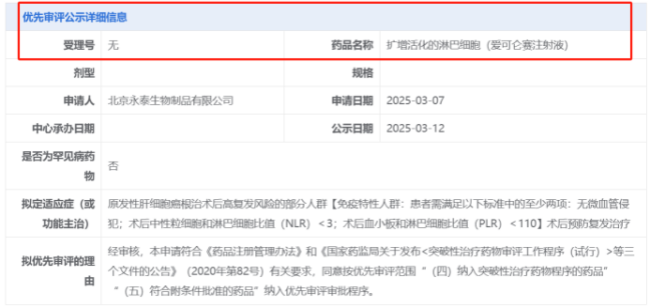
2025年3月13日,国家药品监督管理局药品审评中心(CDE)公示信息显示,永泰生物研发的扩增活化淋巴细胞(Expanded Activated Lymphocytes, EAL)注射液(商品名:爱可仑赛)上市申请获优先审评资格。该细胞免疫疗法拟用于原发性肝细胞癌根治术后高复发风险患者的预防性治疗,适用人群要求符合以下免疫特征标准中的至少两项:无微血管侵犯;术后中性粒细胞与淋巴细胞比值(NLR)<3;术后血小板与淋巴细胞比值(PLR)<110。
EAL疗法作为广谱性细胞免疫治疗产品,已获得CDE突破性治疗品种认定。其技术核心是通过体外扩增患者自体来源的外周血单核细胞,获得以CD8+细胞毒性T细胞(CD3+表型)为主导的混合T淋巴细胞制剂。
关键临床研究进展显示,针对肝癌术后防复发的Ⅱ期临床试验已完成430例目标患者入组。2025年2月,永泰生物与CDE达成共识,允许基于现有数据提交附条件上市申请。此前公布的胃癌Ⅲ期临床数据显示:在84例IIIc-Ⅳ期患者中,EAL治疗组(n=42)经六次以上细胞回输后,中位总生存期(OS)达27.0个月,较对照组(13.9个月)实现统计学显著延长(HR=0.52,p<0.01)。在小细胞肺癌的探索性研究中,EAL治疗组(n=16)同样呈现生存获益趋势。
值得注意的是,该疗法早在2023年即被CDE纳入突破性治疗品种目录,其潜在适应症已扩展至胃癌、小细胞肺癌等多个病种。永泰生物在2024年报中强调,EAL特有的个体化制备工艺可实现标准化规模生产,为实体瘤术后防复发治疗提供了创新解决方案。